EFFISAYILTM 1 es un ensayo clínico fase II multicéntrico, aleatorizado, doble ciego de brazos paralelos y controlado con placebo para evaluar la eficacia, seguridad y tolerabilidad de espesolimab en pacientes con un brote de psoriasis pustulosa generalizada (PPG).1
A continuación, un vídeo resumen sobre EffisayilTM 12:
Los pacientes en brote de PPG tenían una subpuntuación de pústulas GPPGA ≥ 2 (leve, moderada y grave) y una puntuación total GPPGA ≥ 3 (moderada-grave)

53 pacientes2

12 semanas de duración2

Aleatorización 2:1
Espesolimab IV 900 mg : placebo2
DISEÑO DEL ESTUDIO
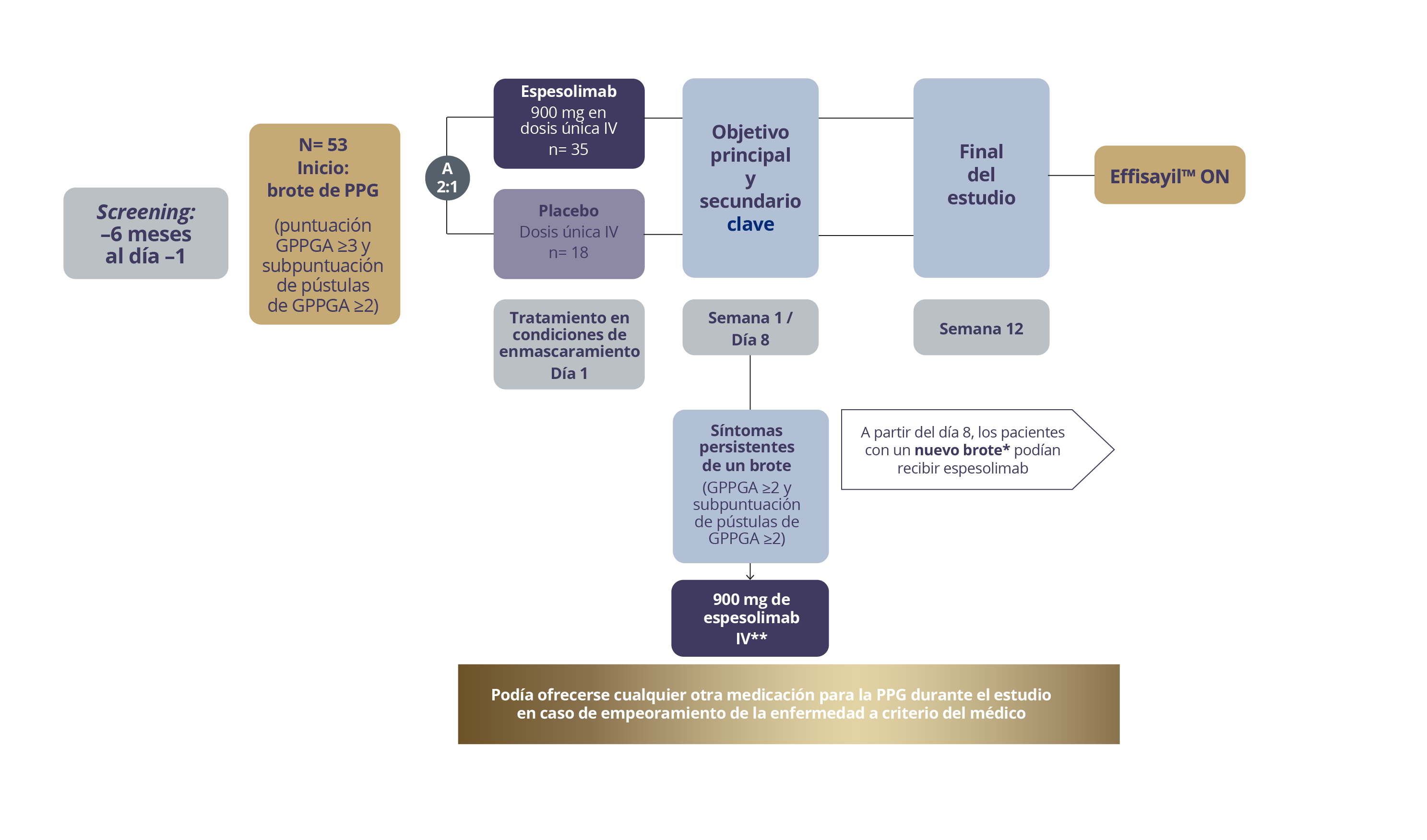
Figura 1. Diseño del estudio EffisayilTM 1. Supplement to: Bachelez H, et al. 2021 N Engl J Med
*Se define como un aumento ≥2 puntos en la puntuación total GPPGA y la subpuntuación de pústulas de GPPGA después de alcanzar una puntuación total GPPGA de 0 o 1. **Los pacientes que han recibido otros medicamentos como tratamiento de la PPG durante la semana 1 no son aptos para recibir espesolimab el día 8.
OBJETIVOS

Objetivo primario:2
- Porcentaje de pacientes con una subpuntuación de pústulas GPPGA de 0
(sin pústulas visibles) en la semana 1.

Objetivos secundarios:2
- Puntuación GPPGA total de 0 o 1
(aclaramiento completo o casi completo de las lesiones cutáneas) en la semana 1. - Reducción ≥75% del GPPASI en la semana 4.
- Cambio en la escala EVA del dolor en la semana 4.
- Cambios en la puntuación PSS en la semana 4.
- Cambios en la escala FACIT de fatiga en la semana 4.
PRINCIPALES RESULTADOS DEL ESTUDIO2
En EffisayilTM 1, espesolimab redujo significativamente la subpuntuación de pústulas de GPPGA (Figura 2) y la puntuación total GPPGA (Figura 3) vs. Placebo, en la semana 1
Subpuntuación de pústulas de GPPGA de 0
(% de pacientes completamente libres de pústulas), en la semana 1
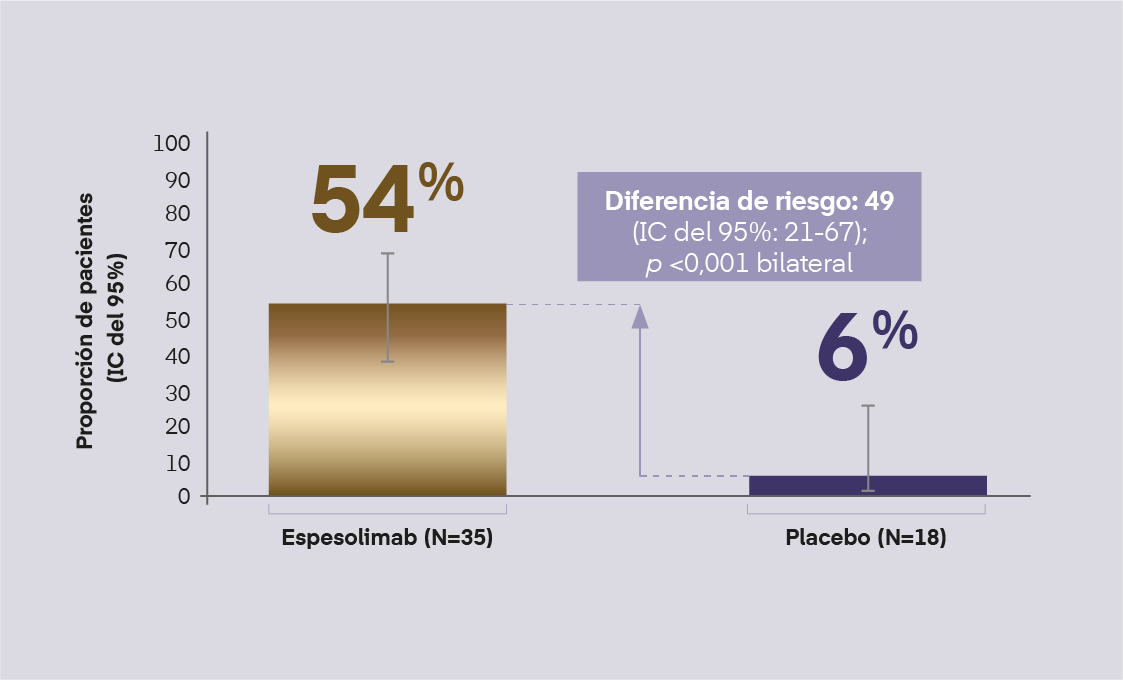
Figura 2. Subpuntuación de pústulas de GPPGA de 0 en semana 1 del EffisayilTM 1. Bachelez, et al. N Engl J Med. 2021
Puntuación total de GPPGA de 0 o 1
(% pacientes con aclaramiento completo o casi completo de todas las lesiones cutáneas), en la semana 1
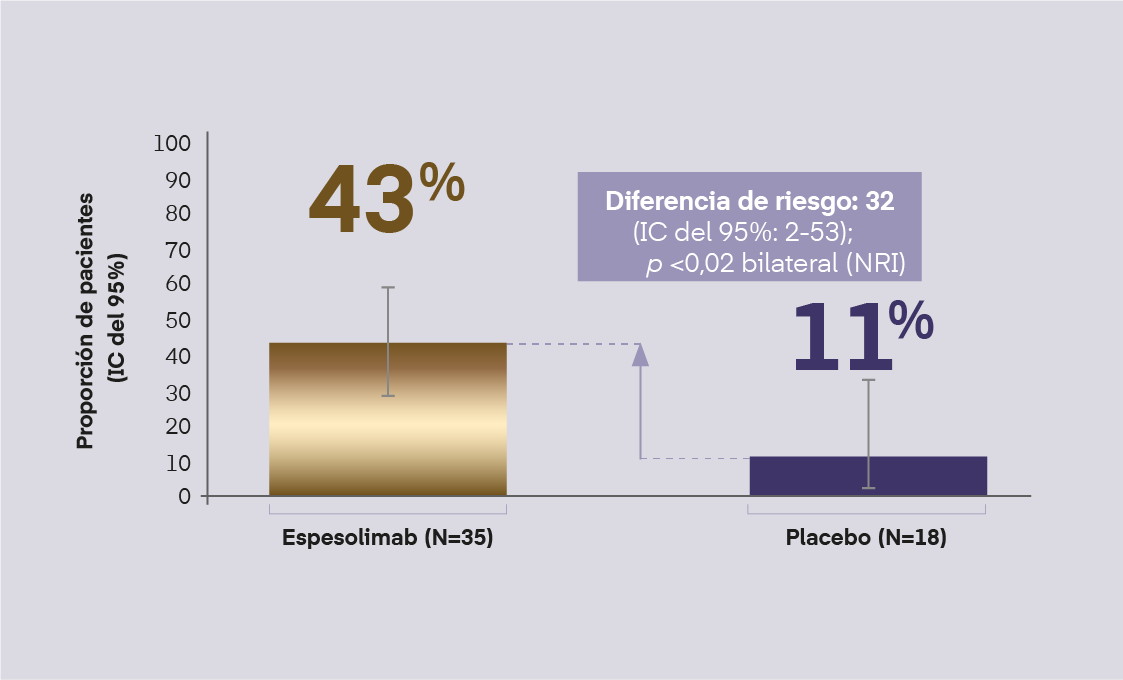
Figura 3. Puntuación total de GPPGA en semana 1 del EffisayilTM 1. Bachelez, et al. N Engl J Med. 2021
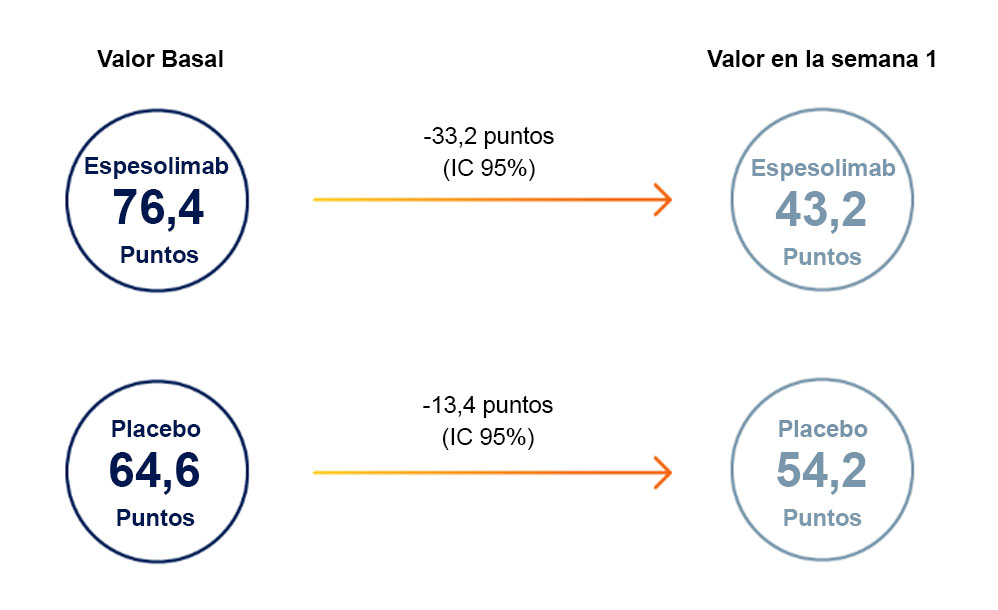
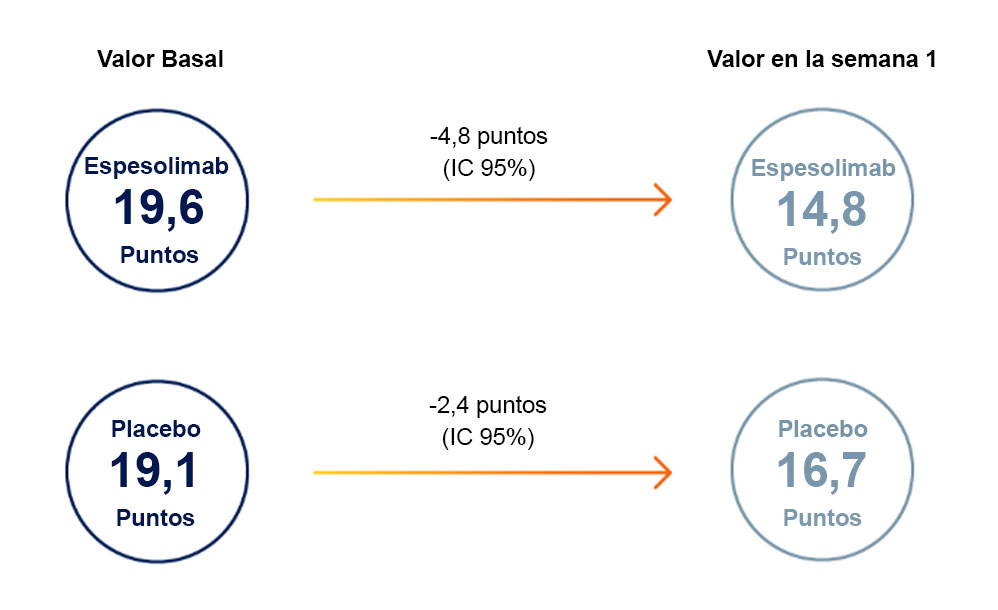
CALIDAD DE VIDA3
El aclaramiento de las pústulas y de todas las lesiones cutáneas se acompañó de mejorías clínicamente relevantes en la escala EVA del dolor y el DLQI.
Reducción en la escala EVA de dolor (0-100):
Reducción en la escala DLQI (0-30)*:
*Evaluación de síntomas y sentimientos, actividades cotidianas, ocio, trabajo, relaciones personales y tratamiento.
SEGURIDAD
Espesolimab demostró un perfil de seguridad favorable en el tratamiento de los brotes de PPG2. Las tasas de acontecimentos adversos fueron similares entre el brazo de espesolimab y el brazo placebo4. A las 12 semanas, la tasa de incidencia de acontecimientos adversos con espesolimab (100 pacientes-año) se redujo en comparación con la semana 12
CONCLUSIONES
- Primer ensayo clínico randomizado, doble ciego, de brazos paralelos con pacientes en brote de PPG con la mayor n de pacientes incluidos y representación de todos los fenotipos1.
- El tratamiento de los brotes de PPG con espesolimab se asoció a un rápido aclaramiento de las pústulas y de las lesiones cutáneas en el 54% y el 43% de los pacientes, respectivamente, en una semana2.
A: aleatorización; EVA: escala visual analógica; FACIT: Functional Assessment of Chronic Illness Therapy–Fatigue; GPPASI: Psoriasis Area and Severity Index for Generalized Pustular Psoriasis; GPPGA: evaluación global del médico para la psoriasis pustulosa generalizada; IV: intravenoso; PPG: psoriasis pustulosa generalizada; PSS: escala de síntomas de psoriasis; IC: intervalo de confianza.
REFERENCIAS
- Choon SE, et al. Study protocol of the global Effisayil 1 Phase II, multicentre, randomised, double-blind, placebo-controlled trial of spesolimab in patients with generalized pustular psoriasis presenting with an acute flare. BMJ Open. 2021;11(3):e043666.
- Bachelez H, et al. Effisayil 1 Trial Investigators. Trial of Spesolimab for Generalized Pustular Psoriasis. N Engl J Med. 2021;385(26):2431-2440.
PPG1234.09.2023

Spevigo 450 mg concentrado para solución para perfusión, 2 viales de 7,5 ml, PVP IVA: 20.130,15€. Con receta médica. Reembolsable por el Sistema Nacional de Salud. Medicamento de uso hospitalario.

